原文链接:和元生物——病毒载体的改造
基础研发目前的主要研究方向为慢病毒(LV)载体改造、腺病毒(ADV)容量改造、腺相关病毒(AAV)血清型筛选、特异性启动子优化、以在体应用为核心的CRISPR/Cas9技术综合开发以及其它的生物学研究工具的研发。
病毒载体是实现基因递送、完成基因操作的关键环节,因此,对病毒载体的改造在研究和应用中有着特殊的重要地位。和元研发部针对病毒载体的改造主要包括腺相关病毒的体内应用改造,包括数十种靶向特异器官血清型、多种类型的AAV血清型文库、慢病毒和腺病毒的改造。
现在研究中常用的rAAV就是利用AAV2型基因组与不同的衣壳蛋白结合产生的混合体病毒载体,一般标记为rAAV2/N (N为不同的衣壳血清型)。重组的病毒具有AAV2型的稳定表达和基因整合能力,同时获得了不同血清型的组织感染嗜亲性(不同血清型衣壳表面的特定结构位点决定了各自受体的特异性),表现出一定的器官靶向特异性。
不同血清型AAV的组织嗜亲性
血清型 | 组织亲和性 |
rAAV2/1 | 神经系统(高滴度顺向跨突触), 肌肉,骨骼肌,心肌,平滑肌 |
rAAV2/2 | 神经系统,肌肉,肝脏, 血管平滑肌,眼 |
rAAV2/3 | 肌肉,肝脏,肺,眼 |
rAAV2/4 | 神经系统,肌肉,眼,脑 |
rAAV2/5 | 神经系统,肺,视网膜, 肝脏,滑膜关节 |
rAAV2/6 | 神经系统,肺,肌肉,心脏 |
rAAV2/7 | 肌肉,肝脏 |
rAAV2/8 | 神经系统,肝脏,胰腺, 视网膜,脂肪组织 |
rAAV2/9 | 神经系统,心肌,肺, 视网膜,皮肤,肌肉,脂肪组织 |
rAAV2-retro | 神经系统(逆向非跨突触) |
AAV-PHP.eB | 跨血脑屏障(静脉注射) |
AAV-PHP.S | 全外周神经(尾静脉注射) |
AAV-PAN | 胰腺(腹腔注射) |
AAV-LUNG | 肺(尾静脉注射) |
AAV-DJ | 视网膜,肺,肾脏, 体外感染细胞 |
AAV-7m8 | 视网膜 |
AAV-ShH10Y | 视网膜Muller细胞 |
AAV-Rh10 | 肝脏,血液,心脏, 体外感染细胞 |
AAV-Anc80L65 | 内耳、视网膜、 骨骼肌、肝脏 |
AAV-SCH9 | SVZ区神经干细胞 |
AAV-2M | 视网膜 |
AAV-BR1 | 脑血管内皮细胞 |
AAV6-TM6 | 小胶质 |
靶向特异器官AAV血清型感染案例
1、rAAV2-retro:神经系统(逆向非跨突触)
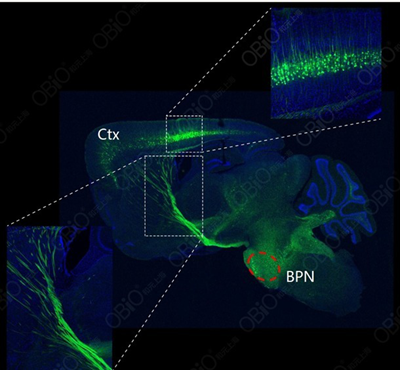
注射部位:小鼠BPN
注射方式:脑定位注射
载体:rAAV2-retro-hSyn-EYFP
观察时间:4周
2、AAV-PHP.eB:神经系统全脑表达(跨血脑屏障)
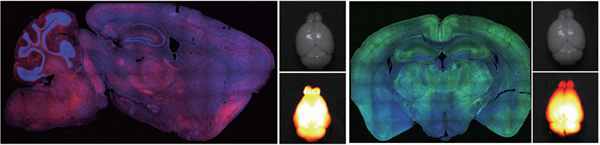
注射方式:尾静脉注射
载体:pAAV-CMV-mScarlet-3FLAG & pAAV-CMV-mNeonGreen-3FLAG
血清型:AAV-PHP.eB
病毒滴度:1.10×1013VG/mL & 2.35×1013 VG/mL
注射体积:200nl(注射病毒总量:1.5×1011 VG)
观察时间:3周
3、AAV-PAN:特异性感染胰腺
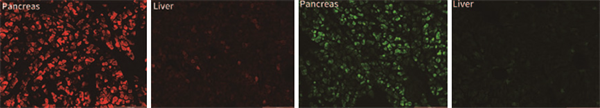
4、AAV-LUNG:特异性感染肺部

注射方式:尾静脉注射载体:pAAV-CMV-mScarlet-3FLAG
血清型:AAV-LUNG
注射量: 2x1011 VG /只(滴度:1.49 x1013 VG/mL),
注射体积:200 uL
观察时间:3周
5、AAV-DJ体外感染293T细胞

AAV-DJ(MOI=105) AAV8(MOI=105 )





 返回
返回























