腺相关病毒(adeno-associated virus, AAV)是微小病毒科(parvoviridae)家族的成员之一,是一类无法自主复制、无被膜的二十面体微小病毒,其直径约20-26nm,含有4.7kb左右的线状单链DNA作为基因组。研究中采用的重组腺相关病毒载体(recombination adeno-associated virus, rAAV)是在非致病的野生型AAV基础上改造而成的基因载体,由于其种类多样、免疫原性极低、安全性高、宿主细胞范围广(对分裂细胞和非分裂细胞均具有感染能力)、扩散能力强、体内表达基因时间长等,rAAV被视为最有前途的基因研究和基因治疗载体之一。
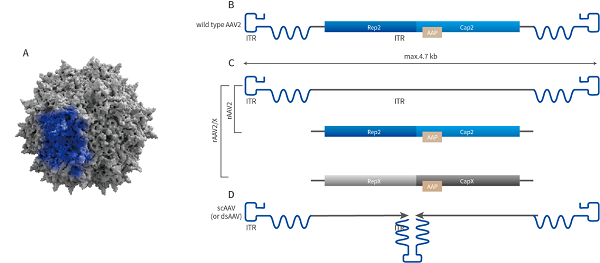
AAV基因组结构
rAAV包装纯化及滴度检测
AAV包装过程中,包装质粒负责编码目的基因以及两个末端反向重复序列(ITR,对于病毒的复制和包装具有决定性作用),辅助质粒包含AAV包装所需的cap(编码病毒衣壳蛋白)和rep(参与病毒的复制)基因,以及腺病毒Helper质粒。三种质粒共同转染293T细胞后,AAV病毒开始复制和包装。和元生物腺相关病毒的生产和质控采取了国际学术界公认的标准流程,采用三质粒系统在293T细胞中进行包装。所获得的病毒颗粒经过超速离心纯化,并通过qPCR对病毒基因拷贝进行滴定。另外,我们也可以根据使用者要求,提供蛋白染色检测衣壳蛋白的完整性以及内毒素含量等。一般情况下rAAV的滴度在1012~1013 VG/ml,完全可以满足各类整体实验的使用要求。
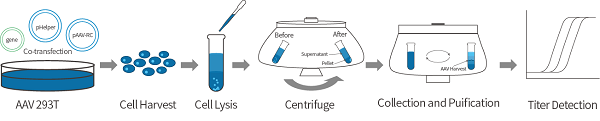
AAV包装流程图
滴度检测方法:定量PCR检测病毒基因组中外源DNA拷贝数。
滴度检测原理:腺相关病毒的基因组为单链DNA,外源DNA拷贝数代表病毒基因组拷贝数。
rAAV侵染细胞过程
纯化后的AAV病毒载体可以用于侵染细胞,侵染细胞时,AAV与细胞表面特异性受体结合,激活胞内信号通路,进而触发AAV通过受体介导的内吞作用进入细胞,在核内体、高尔基体等细胞器的协助下进入细胞核,随后病毒裂解,其单链DNA需复制成为双链DNA后表达目的基因。
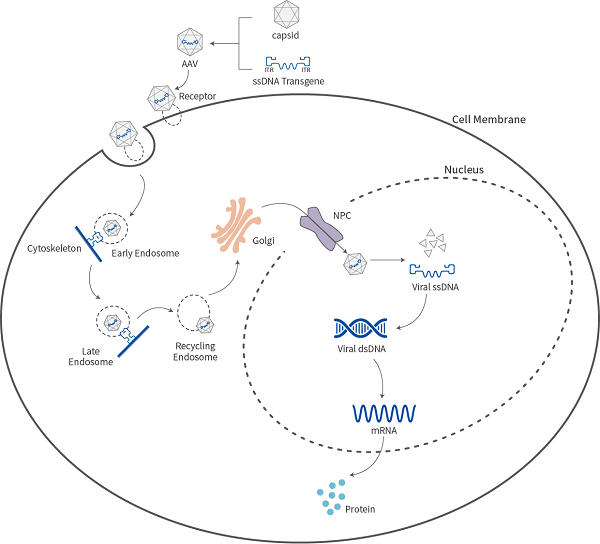
rAAV作用机制
rAAV载体优势
1、安全性高、免疫原性低:AAV是一种复制缺陷型DNA病毒,无自主复制能力,野生型AAV依赖rep基因进行低频定点整合,rAAV不整合。目前尚无由AAV引起的人类及哺乳动物疾病报道,也是FDA批准上市的基因治疗药物中最安全的病毒载体之一。
2、宿主细胞范围广:AAV具有广泛的宿主范围,对分裂细胞和非分裂细胞均具有感染能力。
3、扩散能力强:AAV直径约20-26nm,体积小,滴度高,具有良好的扩散能力,其中AAV-PHP.eB和AAV9具有跨血脑屏障的能力,在神经科学领域应用广泛。
4、体内表达基因时间长:AAV具有保持长期基因转录表达能力,体内表达一般3周可以达到高峰,随后持续高表达,作用时间>5个月。
5、种类多样:AAV血清型众多,此外,根据不同的实验设计,我们还在不断的突变,筛选新的血清型(AAV1-13,AAV2/1, 2/2, 2/5, 2/6, 2/8, 2/9, DJ; retro, PHP.eB…)。
不同病毒的生物学特性比较
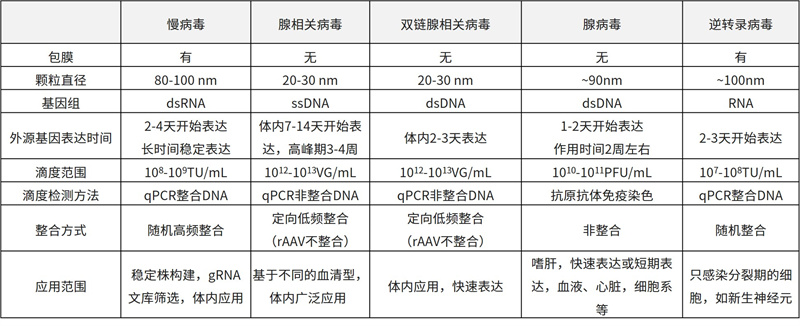
基于上述特点,AAV被视为是一种高效和安全的体外及体内基因转导工具。尤其在整体水平研究中,与其他常用病毒工具载体相比,AAV具有感染过程温和长效的表达能力,是基因操作的利器。
rAAV血清型选择
目前已注册的AAV种类总数已超过196种,灵长类动物体内有13种不同血清型的AAV(即AAV1-AAV13),其中AAV2、AAV3、AAV9源自人类本身,值得注意的是,AAV2是最早被克隆的病毒,也是迄今研究最为彻底、应用最为广泛的病毒载体。随着研究的不断深入,研究人员发现不同血清型的AAV之间可以杂交,而杂交后的AAV会兼有杂合双方的特点,因此,AAV亚型顺势诞生。
现在研究中常用的rAAV就是利用AAV2型基因组与不同的衣壳蛋白结合产生的混合体病毒载体,一般标记为rAAV2/N (N为不同的衣壳血清型)。重组的病毒具有AAV2型的稳定表达和基因整合能力,同时获得了不同血清型的组织感染嗜亲性(不同血清型衣壳表面的特定结构位点决定了各自受体的特异性),表现出一定的器官靶向特异性。
不同血清型AAV的组织嗜亲性
血清型 | 组织亲和性 |
rAAV2/1 | 神经系统(高滴度顺向跨突触),肌肉, 骨骼肌,心肌,平滑肌 |
rAAV2/2 | 视网膜、神经系统, 肌肉,肝脏,血管平滑肌 |
rAAV2/3 | 肌肉,肝脏,肺,眼 |
rAAV2/4 | 神经系统,肌肉,眼,脑 |
rAAV2/5 | 神经系统,肺,视网膜, 肝脏,滑膜关节 |
rAAV2/6 | 神经系统,肺, 肌肉,心脏 |
rAAV2/7 | 肌肉,肝脏 |
rAAV2/8 | 神经系统,肝脏,肌肉, 脂肪组织,胰腺,视网膜, |
rAAV2/9 | 神经系统,心肌,肺, 视网膜,皮肤 |
rAAV2-retro | 神经系统(逆向非跨突触) |
AAV-PHP.eB | 跨血脑屏障(静脉注射) |
AAV-PHP.S | 全外周神经(尾静脉注射) |
AAV-PAN | 胰腺(腹腔注射) |
AAV-LUNG | 肺(尾静脉注射) |
AAV-DJ | 视网膜,肺,肾脏, 体外感染细胞 |
AAV-7m8 | 视网膜 |
AAV-ShH10Y | 视网膜Muller细胞 |
AAV-Rh10 | 肝脏,血液,心脏, 体外感染细胞 |
AAV-Anc80L65 | 内耳、视网膜、 骨骼肌、肝脏 |
AAV-SCH9 | SVZ区神经干细胞 |
小建议:如您不确定选择哪种血清型,可尝试使用和元生物Pandora’s Virus (AAV多种血清型)进行预实验,通过比较不同血清型对目标组织的感染效果,摸索最佳实验条件(注射方法、注射位点、病毒用量等),以便得到更理想的实验结果。
Pandora’s Virus 详情:
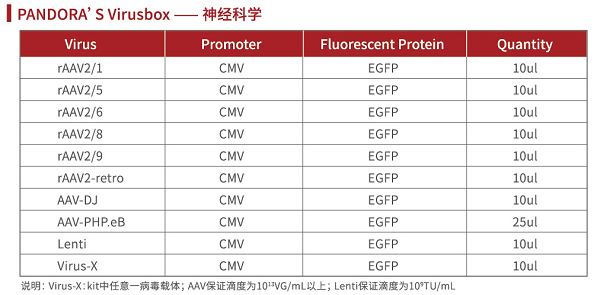

rAAV载体应用案例
1、在神经科学领域中的应用
1.1 外侧缰核&光遗传学
客户发表文章:Nature. (IF=41.577). Yang Y,et.al. (2018). Ketamine blocks bursting in the lateral habenula to rapidly relieve depression. [腺相关病毒, 抑郁症, 光遗传]
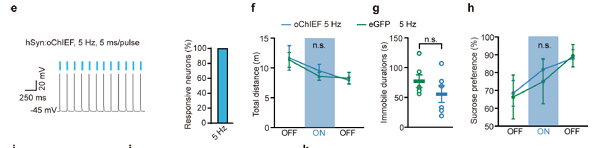
注射部位:小鼠LHb
载体:AAV2/9-hSyn-oChIEF-tdTomato
血清型:AAV2/9
病毒滴度:6.29E+12 VG/mL
注射体积:100nl
观察时间:1个月
1.2 臂旁核&化学遗传学
客户发表文章:Science. (IF=41.058). Mu D,et.al. (2017). A central neural circuit for itch sensation. [腺相关病毒, 痒, 光遗传,化学遗传]

注射部位:小鼠PBN
载体:AAV-hSyn-HA-hM4Di-IRES-mCitrine
血清型:AAV2/9
病毒滴度:1E+13 VG/mL
注射体积:150nl
观察时间:3周
1.3 丘脑&钙离子成像
客户发表文章:客户发表文章:Science. (IF=41.058). Ren S,et.al. (2018). The paraventricular thalamus is a critical thalamic area for wakefulness. [腺相关病毒, 觉醒]

注射部位:小鼠PVT
载体:AAV-CaMKIIα-GCaMP6f
注射体积:100nl
观察时间:4周
1.4 丘脑室旁核&杀死神经元
客户发表文章:Science. (IF=41.058). Ren S,et.al. (2018). The paraventricular thalamus is a critical thalamic area for wakefulness. [腺相关病毒, 觉醒]
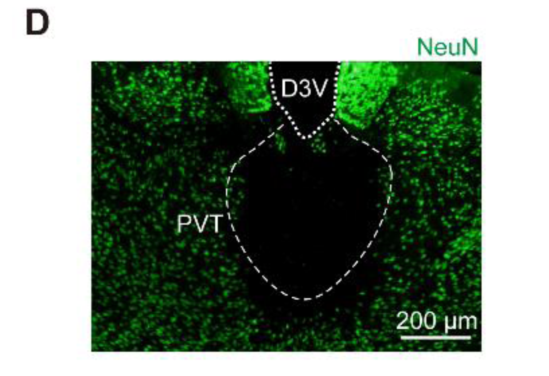
注射部位:小鼠PVT
载体:AAV-CaMKIIα-Cre-GFP &AAV-DIO-caspase-3
注射体积:两支病毒1:1混合注射100nl
观察时间:4周
1.5 海马、皮层&逆向非跨突触(rAAV2/retro)
客户发表文章:Biological Psychiatry. (IF=11.984). Bing Xing Pan,et.al. (2018). Chronic stress causes projection-specific adaptation of amygdala neurons via SK channel downregulation. [腺相关病毒, 焦虑症, 光遗传]
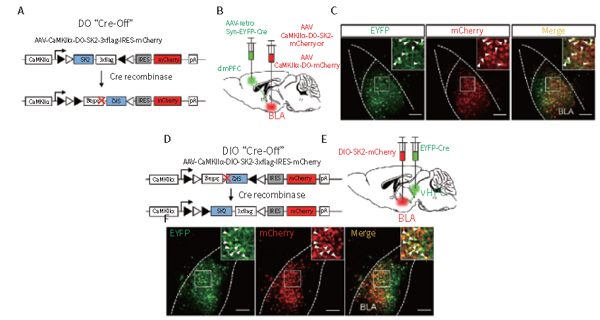
注射部位:小鼠dmPFC、VHPC
载体:AAV2/1-retro-Syn-eYFP-Cre、AAV2/8-CaMKIIα-DO-SK2&AAV2/8-CaMKIIα-DIO-SK2-mCherry
注射体积:300nl
观察时间:4周
1.6 初级运动皮层&顺向跨突触(rAAV2/1)
Nature Neuroscience. (IF=19.912). Yao J,et.al. (2018). A corticopontine circuit for initiation of urination. [腺相关病毒, 神经环路]
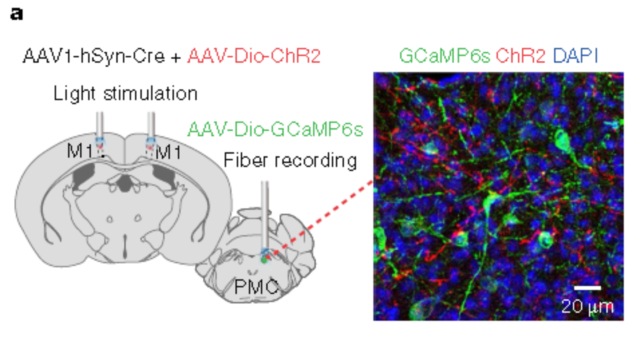
注射部位:小鼠皮层M1、PMC
载体:rAAV2/1-hSyn-Cre&rAAV2/9-DIO-hChR2(H134R)-mCherry、rAAV2/9-DIO-GCaMP6s
病毒滴度:rAAV2/1: 5E+12 VG/mL;rAAV2/9-DIO-hChR2:1.2E+13 VG/mL;rAAV2/9-DIO-GCaMP6s:1E+12 VG/mL
注射体积:多点注射,每位点30-40nl
观察时间:4周
1.7 边缘前皮质&跨突触示踪(WGA-Cre)
客户发表文章:Science Advances. (IF=11.511). Ping Zheng,et.al. (2019). Crucial role of feedback signals from prelimbic cortex to basolateral amygdala in the retrieval of morphine withdrawal memory. [腺相关病毒, 成瘾, AAV1, AAV-WGA-Cre]
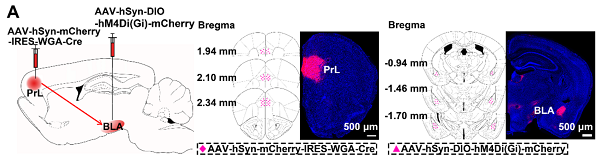
注射部位:小鼠PrL
载体:AAV-hSyn-mCherry-IRES-WGA-Cre
病毒滴度:4.28E+12 VG/mL
注射体积:300nl
观察时间:4周
1.8 皮层&AAV干扰(AAV-shRNA)
客户发表文章:Nature Medicine. (IF=22.864). Cao X,et.al. (2013). Astrocyte-derived ATP modulates depressive-like behaviors.[腺相关病毒, 抑郁症]
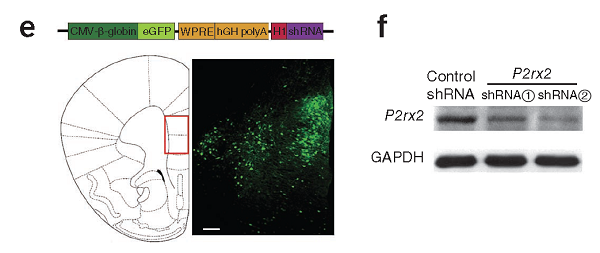
注射部位:小鼠mPFC
载体:AAV-CMV-P2rx2 shRNA-EGFP
病毒滴度:3E+12 VG/mL
注射体积:1.5ul
观察时间:2周
1.9 全脑表达&跨血脑屏障(AAV-PHP.eB)
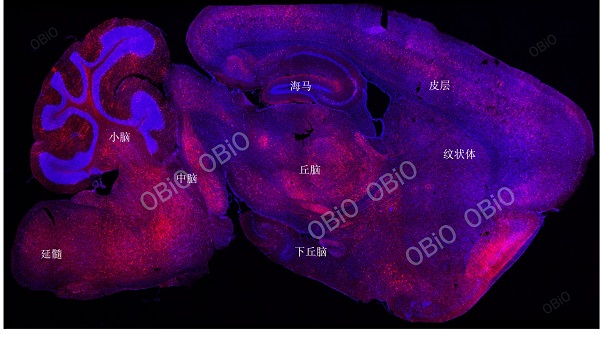
和元生物—rAAV-PHP.eB尾静脉注射感染全脑实例
病毒总量:1.5E+11VG
注射体积:200ul
病毒表达时间:四周
1.10稀疏标记
应用文献:Luo WS, et al., (2016) Supernova: A Versatile Vector System for Single Cell Labeling and Gene Function Studies in vivo. Sci Rep.
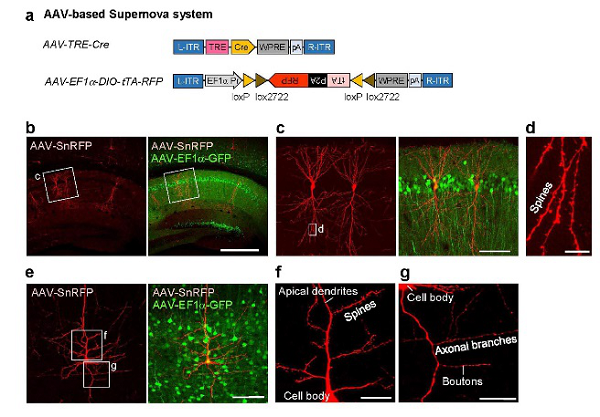
载体信息:pAAV-PTRE-tight-NLS-Cre(108-109VG/mL)、pAAV-EF1a-DIO(tTA-P2A-mScarlet)-WPRE(1012VG/mL)
1.11在视网膜中的应用
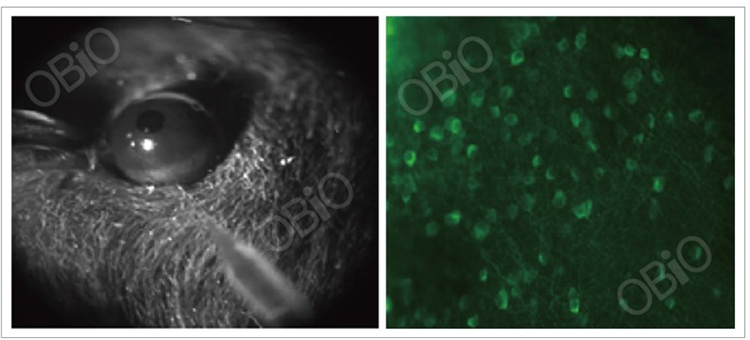
和元生物—玻璃体腔注射
病毒载体:AAV-syn-GcaMP6s
2、在其他脏器中的应用
2.1 rAAV感染肝脏
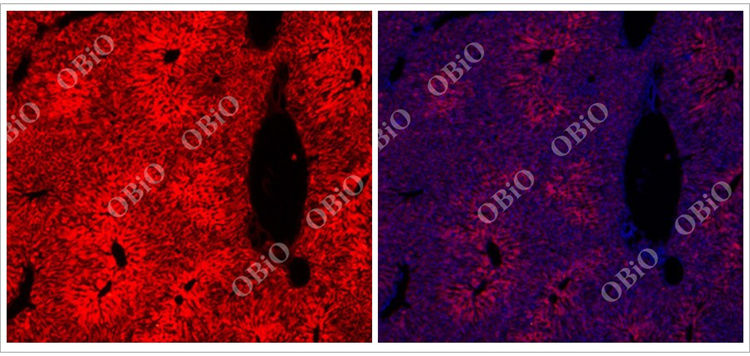
和元生物—rAAV2/8尾静脉注射感染肝脏实例
病毒总量:1E+11VG
注射体积:200ul
病毒表达时间:四周
2.2 rAAV感染心脏
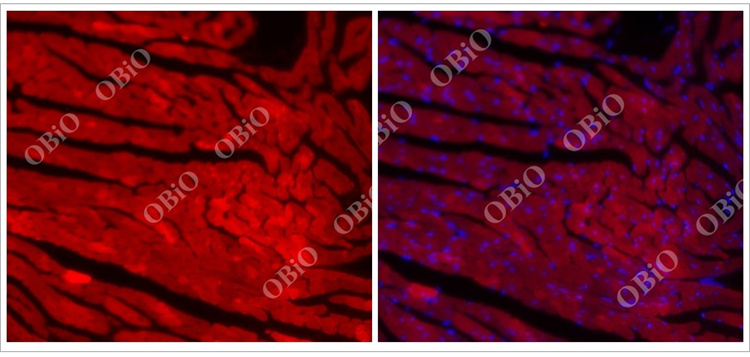
和元生物—rAAV2/9尾静脉注射感染心脏实例
病毒总量:2E+11VG
注射体积:200ul
病毒表达时间:四周
2.3 rAAV感染肺部
 和元生物—rAAV-Lung尾静脉注射感染肺部实例
和元生物—rAAV-Lung尾静脉注射感染肺部实例
病毒总量:5E+11VG
注射体积:200ul
病毒表达时间:二周
客户发表文章:Cell. (IF=36.216). Huijuan Wu,et.al. (2020). Progressive Pulmonary Fibrosis Is Caused by Elevated Mechanical Tension on Alveolar Stem Cells. [腺相关病毒, 干扰]

注射方式:气管注射
感染部位:肺部
载体:pAAV-Tgfb1 shRNA
血清型:rAAV2/9
病毒注射量:1E+11 VG(50ul)
观察时间:3周
2.4 rAAV感染肾脏

和元生物—rAAV2/8尾静脉注射感染肾脏实例
病毒总量:2E+11VG
注射体积:200ul
病毒表达时间:四周
2.5 rAAV感染脂肪组织
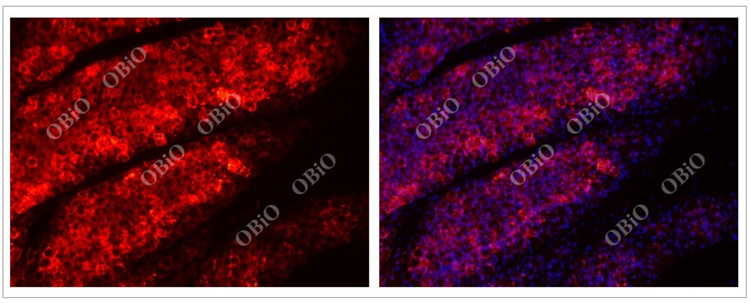
和元生物—rAAV2/8腹股沟脂肪多点注射感染脂肪实例
病毒总量:4E+10VG/侧
病毒表达时间:四周
2.6 rAAV感染肌肉组织

和元生物—rAAV2/8后腿肌肉多点注射感染肌肉实例
病毒总量:4E+10/侧
病毒表达时间:四周
2.7 rAAV感染胰腺
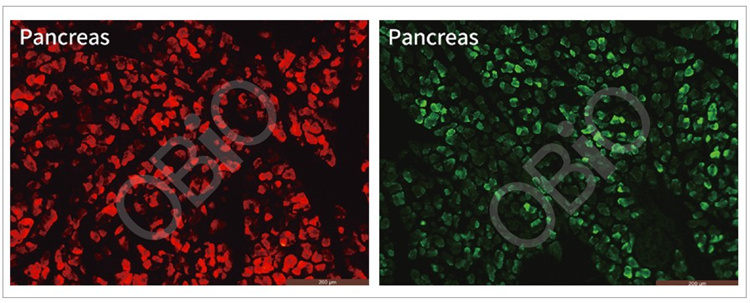
和元生物—rAAV-PAN腹腔注射胰腺实例
病毒总量:4E+11VG
表达检测时间:4周
原文链接:和元生物——腺相关病毒AAV





 返回
返回























